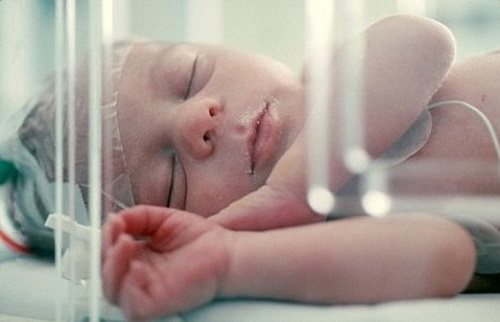
Проблемы лечения ребенка с неврологической патологией являются крайне актуальными в наше время. Это связано и с общим падением рождаемости, и с увеличением количества неблагоприятных факторов, провоцирующих поражение нервной системы, и с учащением случаев рождения нездоровых, физиологически незрелых детей.
Крайне часто непосредственными причинами поражения головного мозга служат гипоксически-ишемические процессы в результате недостаточного снабжения нервной ткани кислородом. В МКБ-10 диагноз шифруется в нескольких разделах. Наиболее близкими по патофизиологии являются коды P21.9 (неонатальная аноксия) и G 93.1 (аноксическое поражение головного мозга, не классифицированное в других рубриках).
Аноксическое поражение нервной системы у детей обусловлено отсутствием адекватного кислородоснабжения нейронов. В подобных условиях клетка быстро изменяет свои функциональные свойства и не способна полноценно работать. В последующем нарушается и морфология нейронов. Дефицит кислорода приводит к клеточному некрозу и/или апоптозу и формирует очаги ишемии в веществе головного мозга. Симптомы аноксии головного мозга могут быть крайне тяжелыми и заканчиваться смертельными исходами.
Нейроны начинают отмирать уже после 4 минут острой аноксии. В условиях гипотермии это время удлиняется до 20-30 минут, при высоких температурах снижается до 120 секунд.
Описание недуга
Проблемы терапии ребенка с неврологическими патологиями являются в наше время крайне актуальными. Это напрямую связано с общим упадком рождаемости, а кроме того, с увеличением количества всевозможных неблагоприятных факторов, которые провоцируют поражение детской нервной системы. Помимо всего прочего подобное во многом связано и с тем, что в современном мире участились случаи рождения нездоровых, а вместе с тем и физиологически незрелых детей.
Очень часто основными причинами аноксического поражения головного мозга выступают гипоксические и ишемические процессы из-за недостаточного снабжения нервных тканей кислородом. В системе МКБ-10 такой диагноз шифруют сразу в нескольких разделах. Самыми близкими по патофизиологии выступает код P21.9 (он подразумевает неонатальную аноксию) и G93.1 (в данном случае речь идет об аноксическом поражении головного мозга, не классифицированном в прочих рубриках).
Нарушение развития мозга на пренатальном этапе онтогенеза
Современные нейробиологические модели шизофрении предполагают повреждение мозговых структур плода еще во внутриутробном периоде.
Развитие нервной системы у эмбриона начинается на 3-й недели беременности под влиянием факторов, выделяемых нотохордой, наряду с формированием нервной пластинки в дорсальной части эмбриона. Эта пластинка расширяется, сворачивается, постепенно формируя нервный желобок. Затем сливается в нервную трубку, которая дает начало развитию головного мозга в своей ростральной части и спинного мозга-в каудальной. К 4-й недели беременности формируются нотохорды, которые замыкаются сзади (каудально) и спереди (рострально). Нарушение замыкания в ростральной части приводит к анэнцефалии, нарушение замыкания в каудальной части — к spina bifida. Ростральная часть нервной трубки перед слиянием расширяется и формирует три первичных мозговых пузыря: прозэнцефалон, мезэнцефалон и ромбэнцефалон. Кроме того, в этот период формируются шейная и мозговая борозды. Первичные мозговые пузыри развиваются в полушария головного мозга, ствол мозга и мозжечок, в то время как из нервного канала формируется желудочковая система мозга. Прозэнцефалон состоит из телэнцефалона, который дает начало полушариям головного мозга и частично базальным ганглиям, другая его часть — диэнцефалон считается предшественником таламуса, гипоталамуса, заднего отдела гипофиза, зрительного нерва и сетчатки. Нейробласты образуются вблизи нервного канала в области вентрикулярной зоны и впоследствии мигрируют не только в соседние области, формируя глубокие подкорковые ядра мозга, но и вдоль радиальных волокон глии, формируя кору больших полушарий. Из этой области незрелого мозга, богатой волокнами глии, развивается белое вещество больших полушарий, при этом некоторая часть радиальной глии дает начало клеткам-предшественникам нейронов зрелого мозга.
| | По каким еще причинам может развиться шизофрения? |
Дисплазию коры мозга стали чаще диагностировать с внедрением в практику методов нейровизуализации.
Сигналы, которые определяют порядок миграции нейронов, в настоящее время активно изучаются, поскольку нарушение процессов миграции приводит к развитию корковой дисплазии и, согласно одной из гипотез, именно из-за этого нарушения, формируется предрасположенность к возникновению шизофрении.
Нейродегенеративные процессы раннего этапа онтогенеза, предрасполагающие к шизофрении
- Искажение процесса миграции нейронов к коре мозга (нарушение миграции «пред-альфа клеток» из нижних в верхние кортикальные слои)
- Ослабление синапсов (слабость синаптической передачи, ограниченность синаптических связей )
- «Лобно-височно-лимбическое сетевое расстройство» (локальные разрывы в сетевой архитектуре нейронов гетеромодального ассоциативного кортекса)
- Изменение процессов пролиферации нейронов и глии (структурные нарушения в аксонах и рецепторах)
Подчеркивается, что при шизофрении можно предполагать стремительно протекающий патологический процесс поражения синапсов. Поэтому повреждения мозга на раннем этапе онтогенеза особенно увеличивают риск развития шизофрении на протяжении последующей жизни человека. Как известно, при шизофрении именно в подростковом возрасте обнаруживается недостаточность синаптических связей, что способствует проявлению симптоматики этого психического расстройства.
Согласно достаточно популярной в ХХ веке гипотезе «нейроразвития», патологический процесс при шизофрении следует считать следствием аномального развития мозга в начальном периоде онтогенеза.
По данным McGrath J. et al., (1995), аномалии мозга больного шизофренией на ранних этапах онтогенеза напоминают тератогенные изменения мозга при алкогольном синдроме плода и являются следствием нарушения развития тканей эктодермы.
В результате этой девиации нейронам не удается мигрировать в «предписанную» область мозга и сформировать необходимые между собой связи. В частности, некоторые исследователи предполагают нарушение миграции, так называемых пред-альфа клеток из нижних в верхние кортикальные слои. Этот процесс может привести к недостаточному развитию определенных областей коры головного мозга. Однако какая именно часть мозга развивается неправильно, сегодня сказать сложно, предположительно это может быть миндалевидное тело, лобные и височные доли мозга.
Одной из популярных гипотез нейродегенеративных нарушений, возникающих в процессе развития мозга при шизофрении, является гипотеза «лобно-височно-лимбического сетевого расстройства». Данная гипотеза предполагает локальные разрывы в сетевой архитектуре нейронов гетеромодального ассоциативного кортекса (Falkai P. et al., 2001).
Морфологические изменения в височно-лимбических структурах мозга при шизофрении слабо выражены и, как правило, не имеют тенденции к усилению, что отчасти подтверждается отсутствием астроглиоза в нервной ткани больных шизофренией по данным постмортальных исследований, а как известно, именно глиоз считается признаком разрушения нейронов, характерным для нейродегенеративных заболеваний.
Патология развития мозга на раннем этапе онтогенеза может проявляться искажением таких нейробиологических процессов созревания нейронов как нейрональная и глиальная пролиферации, «программируемая смерть клетки» (апоптоз), недостаточное развитие рецепторов и синапсов, нарушение образования аксонов.
Сравнение структурно-функциональных изменений мозга в преморбиде больных шизофренией с изменениями нервной ткани после первого эпизода шизофрении отчасти подтверждает дегенерацию нервной ткани еще до появления отчетливых симптомов болезни.
В середине ХХ столетия была популярна гипотеза, согласно которой уязвимость мозга может быть обусловлена поздним возрастом родителей во время зачатия плода — будущего больного шизофренией. Так, в 1959 г. канадские исследователи показали, что возраст родителей шизофренией на момент зачатия ребенка на 2-3 года старше возраста тех родителей, дети которых в дальнейшем были здоровы (Gregory I., 1952). Однако результаты работ других авторов опровергли эти взгляды (Hare E., Moran P., 1979). Последние исследования исследователей из Израиля все же показали, что риск возникновения шизофрении у индивида хотя и незначительно, но возрастает по мере увеличения возраста его родителей, достигая своего максимума при возрасте 55 лет и старше. По сравнению с возрастом 20-24 года, риск развития шизофрении, возрастает почти в два раза при возрасте родителей 55 лет и старше. Можно полагать, что зародышевые клетки женщин могут делиться лишь до определенного периода, в то время как мужские клетки сохраняют способность к делению на протяжении всего репродуктивного периода, как бы накапливая с возрастом риск изменений спермы и, следовательно, мутаций генов, редуцируя правильность DNA репликаций.
В свое время были отмечены факты, касающиеся сезона рождаемости больных шизофренией. Люди, у которых развивалась шизофрения, особенно мужчины, чаще рождались поздней зимой или с февраля по май (Tramer R., 1929). В 1977 г. Torrey et al. опубликовали обзор исследований, посвященных сезонности рождения больных шизофренией. Результаты обзора говорили о том, что у больных шизофренией на 5-8% чаще регистрируется число рождений с декабря по май, причем пик приходился на январь-февраль. Австралийские психиатры также подтвердили зависимость месяца рождения от потенциальной опасности возникновения шизофрении.
Эти факты некоторые исследователи объясняли тем, что женщины находящиеся во втором триместре беременности, если он приходится на зимние месяцы, больше поддвержены инфекционным заболеваниям, в частности, внутриутробной инфекции вирусного гриппа, негативно влияющей на развитие мозга плода в этот период беременности.
В литературе неоднократно приводились данные, подтверждающие эту теорию. Так, например, повышенный уровень заболеваемости шизофренией был отмечен в Голландии во время Второй мировой войны у детей тех женщин, которые голодали в течение первых трех месяцев беременности. По мнению К. Freet и E. Jonston (2005), все перечисленные выше факторы оказывали влияние на мозг, когда он находился в критической стадии своего развития.
Недостаточность питания матери во время беременности, по мнению E. Susser, S. Lin (1992), повышает риск возникновения шизофрении у их детей почти в два раза. В то же время следует отметить, что недостаточность питания будущей матери также сказывается на склонности их детей к заболеванию аффективными расстройствами и предрасполагает к формированию расстройства личности по шизоидному типу (Hoek H. et al., 1996). В исследовании H. HulshoffPol et al. (2000) было показано, что недостаточное питание во время беременности сказывается на объеме желудочков мозга плода, а также на особенностях структуры белого вещества мозга.
Факторы риска повреждения мозга в период онтогенеза, предрасполагающие к развитию шизофрении
- Инфекционные заболевания, возникающие на 5-7 месяце беременности
- Недостаточность питания на 5-7 месяце беременности
- Стресс во время беременности
- Начало беременности поздней весной (увеличивает риск заболевания шизофренией на 10%)
Большинство исследователей шизофрении утверждали, что особенности течения беременности на 5-7 месяце, инфекционные заболевания, возникающие в этот период (Brown A., Susser E., 2002), крайнее значение температур, недостаточное питание были теми факторами, которые усиливали уязвимость созревающего мозга потенциальных больных шизофренией.
Было отмечено, что если мать болела гриппом в среднем триместре беременности, то риск развития шизофрении у ее ребенка увеличивается.
| | Для своевременной качаественной диагностики шизофрении рекомундуем Вам обратиться в психиатрическую клинику |
Достаточно высокий риск возникновения шизофрении имеют те, чьи матери перенесли во втором триместре беременности такие инфекции как: токсоплазмоз гонди (Torrey E., Yolken R., 2003), вирусную краснуху (Brown A. et al., 2000), вирусную инфекцию простого герпеса (Buka S. et al., 2001).
Вирусные заболевания матери, предрасполагающие к последующему развитию шизофрении у детей
- Токсоплазмоз
- Грипп
- Краснуха
- Простой герпес
На неблагоприятную роль стресса, пережитого матерью во время беременности (и в первые пять лет жизни ребенка), в отношении будущего развития шизофрении у ее детей указывали М. Huttunen и Р. Niskanen (1978).
Многие исследователи считают, что наиболее значимо для последующего развития шизофрении повреждение мозга плода во время 5-7 месяца беременности. Выраженные структурные изменения мозга обычно характерны для более раннего периода повреждения плода. Однако значимость повреждения мозга для риска развития шизофрении после 7 месяцев беременности опровергается тем фактом, что глиоз нервной ткани, как отмечалось выше, при данном психическом расстройстве, как правило, не удается обнаружить.
Поскольку реактивный глиоз проявляется только после второго триместра беременности, аномалии мозга в отсутствии глиоза, вероятно, указывают на аномалии развития мозга в противоположность дегенерации.
В исследовании B. Bogerts et al. (1993) признаки глиоза отсутствовали в медиальной темпоральной доле, поясной извилине и в таламусе. В то же время в височной доле были обнаружены такие явления, как уменьшение числа нейронов, изменение их размеров и расположения.
Существуют некоторые гистологические подтверждения того, что отставание речевых функций наблюдается преимущественно при изменении нормального развития коры головного мозга в височных отделах или вокруг сильвиевой борозды.
Часто регистрируемая при шизофрении гетеротопия нейронов гиппокампа (нижний слой гиппокампа), развивающегося на 5-7 месяце после зарождения плода, указывает на опасную для возникновения этого психического расстройства границу беременности.
Экспериментальные исследования на крысах показали, что если сразу после рождения им удалить передние участки гиппокампа или его большую часть, то на протяжении достаточно продолжительного периода «детства» у них не удается вывить существенных отколонений от особенностей развития неоперированных животных. Однако при переходе во взрослый период прооперированные крысы становились бесспокойными, обнаруживали заметное ухудшение памяти и низкую адаптацию к предъявляемым шоковым стимулам.
Анатомическая картина при данном заболевании
К сожалению, медициной до сих пор не выявлен точный механизм появления аноксического поражения головного мозга. Правда, анатомически картина этой патологии достаточно проста. Дело в том, что нервная ткань перестает получать кислород в достаточном для нее количестве, на фоне этого происходит гипоксический ишемический процесс, являющийся, даже в течение короткого временного промежутка, губительным для структуры мозга.
Другими словами, каждый нейрон как бы недополучает в ходе кровоснабжения требуемое ему количество кислорода. Нейроны у детей еще не столь развиты, как это отмечается у взрослых, поэтому и взаимосвязь их с головным мозгом находится лишь на стадии формирования. При малом снабжении клетки она попросту перестает корректно функционировать, и при этом изменяется морфологически и внутренне.
Соответственно, аноксию называют морфологическими дегенеративными процессами, оказывающими на здоровую ткань чрезвычайно пагубное воздействие. Симптомы аноксического поражения головного мозга у детей крайне тяжело переносятся, что нередко заканчивается летальным исходом. Далее разберемся, какие причины являются провоцирующими факторами возникновения этого недуга у детей и новорожденных.
Диагностика
Острая аноксия может быть диагностирована по результатам опроса самого пациента, его родственников или находящихся рядом лиц. Врач выясняет причину возникновения данного состояния и при возможности длительность воздействия травмирующего фактора. Дополнительными методами диагностики являются:
- компьютерная и магнитно-резонансная томография;
- электроэнцефалограмма;
- однофотонная эмиссионная компьютерная томография;
- оценка вызванных слуховых и зрительных потенциалов.
Причины патологии мозга
Единой первопричины для возникновения аноксического поражения головного мозга до сих пор не выявлено. Но стоит заметить, что имеется масса провоцирующих факторов, способных предшествовать столь страшному явлению. Эти факторы могут препятствовать нормальному кровоснабжению, а кроме того, и поступлению требуемого количества кислорода в мозг ребенка:
- Речь идет об остановке сердца или удушье.
- Воздействие интоксикации химическими веществами, например, порой влияние оказывает даже грязная экология. Стоит заметить, что детский организм очень чувствителен к чистоте окружающей среды.
- Разные вирусы наряду с нейроинфекциями.
- Получение солнечного (или теплового) удара и поражение электрическим током.
- Проведение хирургической операции на сердце или на мозге.
- Наступление комы или клинической смерти.
- Влияние длительной артериальной гипотонии (то есть понижение артериального давления).
[править] Примечания
- Категория «Аннексия Крыма (2014)»
- Категория «Присоединение Крыма к России»
| Аннексия головного мозга относится к теме «Украина» | |
| Украина • Украинцы • Украинский язык • Новороссия (ДНР, ЛНР) • Суржик • .ua • .укр • В/на Украине | |
| Люди | Александр Турчинов • Александр Чмыхалов • Алексей Гончаренко • Алексей Гончарук • Анастасия Фоменко • Андрей Ваджра • Андрей Билецкий • Андрей Дещица • Андрей Парубий • Антон Геращенко • Арсен Аваков • Арсений Яценюк • Борис Севастьянов • Борис Филатов • Валерий Гелетей • Виктор Ющенко • Виктор Янукович • Виталий Кличко • Владимир Гройсман • Владимир Зеленский • Георгий Тука • Группа «Грибы» • Денис Шмыгаль • Дмитрий Гордон • Дмитрий Ярош • Евгений Вольнов • Елена Зеленская • Зоряна Макаренко • Игорь Коломойский • Лариса Ницой • Леонид Кучма • Михаил Саакашвили • Николай Азаров • Олег Барна • Олег Леусенко • Олег Ляшко • Олег Тягнибок • Олег Царёв • Олеся Яхно • Павел Климкин • Пётр Порошенко • Руслана • Сашко Билый • Семён Семенченко • Сергей Мельничук • Сергей Тигипко • Степан Полторак • Юлия Витязева • Юлия Тимошенко • Юрий Береза |
| Евромайдан | Бандера придёт, порядок наведёт • Декоммунизация • Комуняку — на гілляку! • Кто не скачет, тот москаль • Майдан, грёбаный стыд • Майдауны • Москаляку на гилляку • Слава Украине, героям слава! • Игорь Стрелков (сообщения) • Одесская Хатынь • Хочу кружевные трусики и в ЕС |
| Сайты и компании | Аплинк • ВСети.co • ЕСвое • Земля Роду нашого • ИнформНапалм • Миротворец • ПДРС • РБК-Украина • The Ukrainians • Torrents.net.ua • Чоткий паца • Шарий.net • French-Ukrainian Journal of Chemistry • m-translate.com.ua • Prozorro • Soft Xpansion Ukraine • Ukrainians • Ukr.net • UkrOpen |
| Мемы и именования | Аннексия головного мозга • Бандеровцы (жидобандеровцы) • Боевой суржик • Вежливые люди • Визитка Яроша • Вышиватник • Галицаи • Дякую тобі, Боже, що я не москаль • Кацапы • Киборги • Колорады • Крымчанка, дочь офицера • Морекопатели • Печеньки Госдепа • Поребрик • Порошкович • Правосеки • Русская оккупация • Свидомиты • Украина не Россия • Украинский Юпитер • Укропы • Укры • Хохлосрач • Чипидрис • Чоткий паца • Новороссия-тян • Зорян и Шкиряк |
| Разное | Лимиты электронных денег на Украине (2014) • Никогда мы не будем братьями • Пранк Коломойского • Русские не славяне • План «Шатун» • Украинские националисты в Википедии • Украинский национальный антивирус • Языковая шизофрения |
Симптоматика этой опасной патологии
Аноксическое поражение головного мозга у новорожденных, как правило, проходит крайне тяжело. Дело в том, что даже наступление кратковременной гипоксии может вызывать приступ удушья наряду с судорогами и внутренним некрозом. К общей симптоматике и признакам аноксии относят:
- Наличие у ребенка эпилептических припадков и судорог.
- Присутствие непроизвольного дрожания конечностей.
- Возникновение нарушения чувствительности.
- Появление сбоя в работе органов слуха и зрения.
- Возникновение светобоязни и повышенной светочувствительности.
- Появление паралича и парезов конечностей.
- Возникновение приступов удушья и нарушения в дыхании.
- Появление сбоя сердечного ритма.
- Возникновение головных болей.
Диагностика данной патологии мозга
Диагностика аноксического поражения головного мозга у детей предполагает прежде всего проведение магнитно-резонансной и компьютерной томографии. Также может понадобиться электроэнцефалография. По результатам всех этих процедур врач может установить верный диагноз и спрогнозировать дальнейшее протекание недуга.
Лечение, как правило, включает в себя два последовательных этапа. Во-первых, это удаление первопричин заболевания наряду с восстановлением организма. На этом этапе необходимо разобраться с тем, что именно послужило причинами аноксии, чтобы устранить ее. А непосредственно на втором этапе требуется прием витаминов наряду с дыхательными тренировками и приемом сосудистых препаратов в целях восстановления работы сердца и сосудов в том числе.
Как и где лечится аноксическое поражение головного мозга?
Преждевременные роды являются главной причиной младенческой смертности и серьезным фактором утраты человеческого потенциала выживших детей в течение последующей жизни. По данным зарубежных авторов, во всем мире ежегодно рождаются несколько миллионов детей с очень низкой массой тела (ОНМТ) [1]. В США 90% из 65 000 новорожденных младенцев с ОНМТ переживают неонатальный период из-за больших успехов в интенсивной терапии, однако у 5—10% этих детей позже обнаруживают детский церебральный паралич [2].
Внедрение современных медицинских технологий в последнее десятилетие отмечено снижением перинатальной и младенческой смертности. Вместе с тем повышение коэффициента выживаемости детей с ОНМТ и экстремально низкой массой тела (ЭНМТ) при рождении влечет за собой повышение заболеваемости и формирование ранней инвалидности [3]. Среди причин детской инвалидности патология нервной системы занимает первое место, а вклад перинатальных поражений достигает 60—80% всех неврологических заболеваний [4]. В России ежегодно из числа освидетельствованных инвалидов с детства признаются трудоспособными не более 2,5—5% по сравнению с 50% за рубежом [5].
Среди факторов, неблагоприятно влияющих на антенатальный период, большое значение имеет нарушение маточно-плацентарного кровообращения, причиной которого могут быть как экстрагенитальная, так и соматическая патология матери [6]. Нарушения маточно-плацентарного кровотока в свою очередь приводят к развитию гипоксии, являющейся центральным звеном патогенеза антенатального повреждения плода, и в первую очередь центральной нервной системы (ЦНС). В работах многих авторов установлен целый комплекс физиологических приспособительных реакций плода к неблагоприятным условиям развития, в частности к гипоксии [7—10]. Однако информации о биохимическом статусе нервной ткани плода и новорожденного при данной патологии недостаточно. Большой интерес в этом плане представляет изучение метаболизма глюкозы, особенностей свободнорадикального окисления и обмена глутамата, процессов некроза и апоптоза.
Внутриутробно плод находится в состоянии гипоксии, однако эта среда для него является физиологической, более того, на ранних этапах эмбрионального периода она необходима для нормальной дифференцировки клеток. Оксигенация плода зависит от градиентов парциального давления кислорода между материнской и плацентарной кровью, плодной кровью и плодной тканью. Известно, что в первые недели после зачатия в эмбриональном периоде уровень парциального давления кислорода (рО2) чрезвычайно низок и составляет около 18—20 мм рт.ст. Предположительно, это необходимо для защиты эмбриона, который очень чувствителен к повреждающему действию реактивных форм кислорода [11]. Гипоксия в эмбриональном периоде вызывает ангиогенез и является предпосылкой для поддержания плюрипотентности стволовых клеток [12]. Примечательно, что в I триместре беременности эмбриональные стволовые клетки развиваются при уровне рО2 около 10—15 мм рт.ст., тогда как в эндометрии рО2 составляет около 25 мм рт.ст. Стволовые клетки демонстрируют более эффективный рост и дифференцировку при низких давлениях кислорода — 10—15 мм рт.ст. [13]. Длительная гипоксия будет стимулировать ангиогенез посредством транскрипционной и посттранскрипционной регуляции факторов роста: фактор роста эндотелия сосудов, эритропоэтин, фактор роста плаценты и ангиопоэтин1 [14].
Основным регулятором адаптивных ответов клетки на гипоксию является индуцированный гипоксией фактор1 (ИГФ-1), гетеродимерный транскрипционный фактор, включающий субъединицы (ИГФ-1α и ИГФ-1β). ИГФ-1α стабилизируется, когда концентрация кислорода ниже определенного критического порога, таким образом, накапливаясь в гипоксической среде. ИГФ-1β присутствует в ядре клетки, и в условиях гипоксии он димеризуется с ИГФ-1α, улучшая доставку кислорода в ткань [15, 16]. На 14—16-й неделе беременности рО2 поднимается до стабильных значений 45—50 мм рт.ст. и сохраняется таковым до конца беременности. На поздних сроках беременности скорость пролиферации и дифференцировки клеток снижается [17, 18]. Процессы перекисного окисления липидов присутствуют с самого начала беременности, что способствует нормальному развитию плода. В конце I триместра физиологический окислительный стресс вызывает регрессию ворсинок, которые были сформированы на всей поверхности хорионического мешка, чтобы сформировать окончательную дискоидную плаценту [19]. Постнатальное увеличение концентрации кислорода вызывает всплеск образования его активных форм, при этом экспрессия антиоксидантных ферментов, таких как супероксиддисмутаза, каталаза и глутатионпероксидаза, динамически увеличиваются в течение последних недель беременности. Аналогичным образом повышается доступность наиболее важных неферментативных антиоксидантов: глутатиона, гемоксигеназы, витаминов С и Е, β-каротинов и т. д. [20]. Недоношенный ребенок более подвержен риску свободнорадикального повреждения [21]. Считается, что использование высоких концентраций кислорода во время реанимации новорожденных вызывает гипероксемию. При этом была обнаружена значительная корреляция между окисленным глутатионом (GSSG), рО2 и активностью ферментов окислительно-восстановительного цикла глутатиона [22, 23]. Многие заболевания, связанные с недоношенностью, такие как ретинопатия, бронхолегочная дисплазия, внутрижелудочковые кровоизлияния, связаны со свободнорадикальным повреждением в результате незрелости антиоксидантной системы недоношенных детей [24].
Нервная ткань является наиболее уязвимой при воздействии гипоксии. Гипоксия приводит к нарушению обмена кислорода и углекислоты, что в свою очередь вызывает метаболические расстройства и гемодинамические нарушения [25]. Известны следующие механизмы, лежащие в основе церебрального повреждения при гипоксии-ишемии: местные нарушения обмена макроэргических соединений, чрезмерное перекисное окисление липидов и нарушение Na+/K+-АТФазной активности, внеклеточное накопление К+ и внутриклеточное накопление Са2+, внутриклеточный ацидоз, нарушение обмена нейротрансмиттеров [26]. Основные звенья гипоксически-ишемического стресса представлены P. Marro [27].
— Недостаток кислорода. Дефицит кислорода как акцептора электронов в тканях приводит к нарушению транспорта электронов в цикле Кребса и дыхательной цепи, восполнению энергии путем увеличения мозгового кровотока и анаэробного метаболизма [28].
— Глутамат-кальциевый каскад. Повышение концентрации глутамата активирует N-метил-D-аспартат (NMDA)-рецепторы, что сопровождается увеличением внутриклеточного Са2+ [29]. Нарушения в митохондриях и эндоплазматическом ретикулуме могут привести к дальнейшему накоплению внутриклеточного Ca2+. Повышение концентрации Са2+ внутри клетки способствует образованию свободных радикалов, что в свою очередь вызывает перекисное окисление липидов клеточной и внутриклеточной мембран. Наряду с этим накопление внутриклеточного Са2+ закономерно сопровождается повышением его концентрации в ядре клетки. Избыток внутриядерного Са2+ является фактором активации протоапоптотических генов, которые запускают генетически запрограммированную гибель клетки — апоптоз [30].
— Роль свободных радикалов. Гипоксия-ишемия вызывает неадекватное насыщение митохондриальной цитохромоксидазы, нарушение транспорта электронов в митохондриях, что приводит к повышению концентрации супероксид-аниона и поступлению свободных радикалов из митохондрий в цитоплазму [31]. Повышение концентрации внутриклеточного Са2+ активирует NO-синтетазу, циклооксигеназу и липооксигеназу, что способствует образованию свободных радикалов. Их избыток приводит к дополнительному высвобождению возбуждающих аминокислот и активации NMDA-рецепторов [32].
— Факторы воспаления. Действие гипоксии — ишемии на микроглию способствует синтезу цитокинов, интерлейкина-1β (ИЛ-1β), фактора некроза опухоли α (TNFα) [33]. Активность ИЛ-1β сопровождается продукцией специфических протеаз и развитием апоптоза. Избыточное образование TNFα обладает прямым токсическим эффектом и вызывает сосудистую инфильтрацию с высвобождением цитотоксических факторов, активных форм кислорода и цитокинов [34].
— Роль оксида азота (NO). NO-синтетаза содержится в эндотелиальных клетках, астроцитах, нейронах. Существует 3 изоформы NO-синтетазы: нейронная (регулирует синаптогенез и ремоделирование и зависит от Са2+); эндотелиальная (регулирует сосудистый тонус, особенно вазодилатацию, и зависит от Са2+); индуцируемая (присутствует в макрофагах и астроцитах, индуцируется цитокинами, независима от Са2+) [35]. Активация NMDA-рецепторов вызывает продукцию нейронной NO-синтетазы, которая способствует образованию радикала оксида азота (NO.) и повреждению нейрональной ДНК [36].
— Апоптоз. Описанные выше процессы развиваются в первые минуты острой гипоксии, после чего включается механизм апоптоза [37]. Гипоксия через ряд звеньев патогенеза способствует накоплению внутриклеточного Са2+, активации эндонуклеаз, повреждению экспрессии генов. Это приводит к растормаживанию фагоцитарной активности глиальных клеток и нейронов, которые фагоцитируют поврежденный нейрон, вызывая уменьшение его размера и секвестрацию [38].
Наиболее значительные потери клеток нервной ткани развиваются спустя 2—6—48 ч после рождения, вследствие патологического окислительного стресса. В таких условиях в первые часы и сутки жизни после рождения у новорожденных, перенесших гипоксию, развивается выраженный дисбаланс в системе регуляции церебрального кровообращения, который обостряет течение ишемического процесса [39].
Особенностью недоношенных детей является незрелость антиоксидантной системы, поскольку физиологическое увеличение антиоксидантной способности происходит в конце беременности, именно поэтому они более подвержены воздействию окислительного стресса, особенно когда их состояние требует проведения респираторной терапии [40]. В связи с этим возникает необходимость изучения окислительного стресса у этих детей, в частности путем измерения продуктов перекисного окисления липидов и компонентов антиоксидантной системы.
Известно, что антиоксиданты обладают противовоспалительной активностью, а систему глутатиона рассматривают как критический фактор развития воспаления и иммунных ответов [41, 42]. Это подтверждается изменением уровня цитокинов, острофазных белков и глутатиона во время воспаления [43, 44]. Система глутатиона включает его формы, ряд ферментов его синтеза и катаболизма, и механизмы транспорта. Все эти компоненты вносят важный вклад в изменение глутатионового статуса [45].
Изучая классификацию церебральных поражений у новорожденных, необходимо отметить, что наиболее популярной у неонатологов является классификация гипоксической энцефалопатии по H. Sarnat и M. Sarnat [46]. Она объединяет клинические признаки церебральной ишемии и результаты электроэнцефалографии (ЭЭГ). В данной классификации оцениваются основные показатели новорожденного: уровень сознания, нерво-мышечный статус, рефлексы, вегетативная функция, наличие судорог, ЭЭГ. В зависимости от выраженности церебральной дисфункции устанавливают I, II или III стадию энцефалопатии. Канадские неонатологи модифицировали классификацию Sarnat, дополнив ее расстройствами терморегуляции и исключив ЭЭГ и некоторые другие показатели [47]. Неонатологи Великобритании используют классификацию гипоксических церебральных нарушений L. Dubowitz и соавт.[48]. В международной классификации болезней 11-го пересмотра (МКБ-11) гипоксически-ишемические поражения головного мозга у новорожденных относятся к группе «неврологических расстройств, характерных для перинатального и неонатального периодов» [49]. Основным отличием от классификации 10-го пересмотра является то, что в МКБ-11 данная группа дополнена заболеваниями, которые ранее не выделяли отдельно. Например, перинатальный артериальный инсульт и неонатальный церебральный синовенозный тромбоз. В то же время из предложенной классификации была исключена врожденная гидроцефалия. Диагноз асфиксии новорожденного поместили в «группу других нарушений, возникающих в перинатальном периоде». При этом отдельно выделили асфиксию новорожденного с оценкой по шкале Апгар 0—3 балла и асфиксию новорожденного с оценкой по шкале Апгар 4—6 баллов. Что касается церебральных повреждений гипоксически-геморрагического характера, то их отнесли к группе «геморрагических и гематологических нарушений у плода и новорожденного». При этом несколько изменилась классификация внутрижелудочковых кровоизлияний. В МКБ-11 принято выделять 4 степени внутрижелудочковых кровоизлияний, в то время как в МКБ-10 3-я и 4-я степени были объединены.
Симптомы тяжелого повреждения ЦНС могут проявляться не сразу после рождения, а спустя несколько часов. При этом клиническая симптоматика не всегда отражает истинную степень тяжести заболевания. В связи с этим особую актуальность приобретает прижизненная оценка изменений, возникающих в клетках нервной ткани в раннем неонатальном периоде. Ультразвуковое исследование (УЗИ) позволяет выявить структурные изменения головного мозга новорожденных при перинатальном гипоксическом поражении ЦНС. Анализ ультразвуковых и патоморфологических данных свидетельствует о том, что характер ишемического поражения головного мозга зависит не только от тяжести перинатальной гипоксии, но и от зрелости ребенка [50]. У доношенных новорожденных ишемия мозга сопровождается возникновением избирательного нейронального некроза, субкортикальной и мультикистозной энцефаломаляциями, инфарктами мозга [51]. Тяжелая перинатальная гипоксия у недоношенных 34—37-й недель гестации, как правило, приводит к развитию перивентрикулярной лейкомаляции. В связи с выхаживанием глубоко недоношенных детей с ЭНМТ при УЗИ стали чаще выявлять такие формы ишемического повреждения, как диффузная лейкомаляция и перивентрикулярный геморрагический инфаркт. Следует отметить, что в первые 24—48 ч дебюта неонатального артериального ишемического инсульта данный метод не обладает достаточной чувствительностью и специфичностью, так как очаг ишемического поражения начинает появляться только на 2—3-и сутки от начала ишемии, что связано с ходом патогистологических процессов. Выраженность воспалительной реакции, интенсивность некроза и апоптоза достигают своего пика через 48—72 ч после нарушения кровообращения [52]. Это приводит к изменению эхогенности поврежденной мозговой паренхимы. Дальнейшая оценка эволюции ишемического очага не уступает по информативности магнитно-резонансной томографии (МРТ) [53, 54]. Повысить чувствительность УЗИ на ранних сроках церебрального повреждения помогает применение ультразвуковой допплерографии. Дуплексное сканирование позволяет объективно оценить гемодинамические характеристики церебральных сосудов. Ценность ультразвуковой допплерографической методики в остром периоде заболевания — выявление фазы вазодилатации, наиболее раннего признака ишемического повреждения, возникающего уже через 30 мин после развития сосудистой катастрофы и сохраняющегося в течение первых 5—6 сут [55]. Вазодилатация развивается в ответ на действие различных метаболитов и способствует увеличению поступления в ишемизированную ткань глюкозы и кислорода. Ее характерными признаками являются повышение скорости кровотока и снижение индексов периферического сопротивления в поврежденном сосудистом бассейне [56, 57]. МРТ стала наиболее информативным методом диагностики перинатальных повреждении головного мозга. Наличие различных импульсных последовательностей обеспечивает высокую чувствительность и специфичность, даже на ранних сроках развития сосудистой катастрофы [58, 59]. МРТ с получением диффузионно-взвешенных изображений и построением карт измеряемого коэффициента диффузии (ИКД) позволяет выявить ишемический очаг уже через 30 мин от момента его возникновения. ИКД служит количественной характеристикой диффузии в ткани и отражает наличие внутриклеточного отека [60]. Представленные диагностические методы необходимы для выявления, определения локализации, степени тяжести повреждения мозга и прогноза. Недостатками их являются короткий временной диагностический интервал и ограниченная возможность повторного исследования [61]. В течение последних 20 лет для прогнозирования исходов церебрального повреждения у новорожденных изучается диагностическая ценность биомаркеров [62, 63]. Учитывая патофизиологические изменения, происходящие в результате повреждения ткани головного мозга, были подробно изучены нейропротеины, кальций-связывающий белок, вазоактивные вещества, маркеры окислительного стресса, медиаторы воспаления и т. д. [64—67]. Однако, несмотря на перспективность изучения биомаркеров, отсутствуют данные о практическом их применении в медицине.
Лечение гипоксических поражений головного мозга является предметом жарких дискуссий и крайних мнений — от полного отказа в необходимости лечения нейротропными препаратами до агрессивной полипрагмазии [26]. Согласно современным воззрениям гипоксически-ишемическая энцефалопатия возникает при асфиксии, как правило, в структуре полиорганных расстройств, поэтому основной принцип терапии заключается в выведении ребенка из асфиксии и поддержании витальных функций [68]. Специфическое лечение гипоксически-ишемической энцефалопатии — терапия отека головного мозга и нейропротекция, которая подразумевает в первую очередь контроль объема цереброспинальной жидкости (ЦСЖ), церебральной перфузии и объема вещества мозга. Церебральная перфузия зависит от артериального притока, венозного оттока и интенсивности метаболизма нервной ткани. На этом этапе большое значение имеет адекватность проводимой искусственной вентиляции легких и эффективность гипотермии. Необходимо отметить, что гипотермия проводится у новорожденных с гестационным возрастом не менее 36 нед при наличии по крайней мере одного из признаков, изложенных в специальных критериях [69]. Контроль объема жидкости в ЦСЖ-путях осуществляется за счет торможения выработки ЦСЖ и улучшения ее оттока. Контроль объема мозга подразумевает усиление активного транспорта и стабилизацию мембран нейронов. Следует отметить, что на данный момент применение лекарственных препаратов в неонатологии ограничено из-за высокого риска развития побочных эффектов и отсутствия доказательной базы. Однако поиск таких препаратов продолжается по настоящее время. В частности, за последние два десятилетия произошли значительные изменения в понимании роли эритропоэтина в качестве нейропротектора. Доказано, что эритропоэтин участвует в нейрогенезе и ангиогенезе во время эмбрионального развития и активируется после травмы головного мозга [70], а также оказывает цитопротективное действие на эндотелиальные, глиальные клетки и нейроны [71]. Впервые нейропротективная роль эритропоэтина была выявлена в нескольких исследованиях in vitro
и in vivo [72]. При этом удалось выяснить, что эритропоэтин обладает антиапоптотическим [73], антиоксидантным [74] и противовоспалительным эффектами [75]. Кроме того, он ослабляет эффекты воспаления, снижая реактивный астроцитоз и подавляя активацию микроглии, и уменьшает количество иммунных клеток в месте воспаления [76]. Известно, что отсутствие эндогенного эритропоэтина увеличивало ишемическое повреждение головного мозга и ухудшало выживаемость нейронов [77]. Установленные защитные эффекты эритропоэтина во время ишемии и реперфузии побудили использовать рекомбинантный эритропоэтин у недоношенных детей с церебральной ишемией, внутрижелудочковыми кровоизлияниями и перивентрикулярной лейкомаляцией [78]. Так, в одном из исследований оценивали эффективность и безопасность применения эритропоэтина при неонатальной гипоксически-ишемической энцефалопатии. В данное исследование были включены 167 новорожденных с умеренным и тяжелым церебральным поражением. Всех детей разделили на две группы. Дети первой группы получали стандартную терапию гипоксически-ишемической энцефалопатии, а детям второй группы к стандартной терапии был добавлен эритропоэтин в дозировке 300 и 500 ЕД/кг. Препарат вводили в первые 48 ч через день в течение 2 нед. Оказалось, что летальность и инвалидность на 19,2% чаще встречалась в группе детей, не получавших эритропоэтин [79].
Таким образом, проблема церебрального повреждения ишемического типа у недоношенных новорожденных является весьма актуальной. Прежде всего это подтверждается высокой частотой встречаемости данной патологии и большим риском летального исхода и инвалидизации детей. Остается открытым вопрос комплексной диагностики церебральных нарушений у недоношенных детей, потому как не существует единого алгоритма, объединяющего данные клинической картины, инструментальных и лабораторных методов исследования. Большой интерес представляет поиск предикторов неблагоприятного исхода с целью оптимизации лечебных подходов.
Авторы заявляют оботсутствии конфликта интересов. The authors declare no conflicts of interest.
Сведения об авторах
Анурьев А.М. — https://orcid.org/0000-0002-6724-5067; e-mail
Горбачев В.И. — https://orcid.org/0000-0001-6278-9332
Как цитировать:
Анурьев А.М., Горбачев В.И. Гипоксически-ишемические поражения головного мозга у недоношенных новорожденных. Журнал неврологии и психиатрии им. С.С. Корсакова.
2019;119(8 вып. 2):63-69. https://doi.org/10.17116/jnevro201911908263
Автор, ответственный за переписку:
— Анурьев Алексей Михайлович — e-mail
Методы борьбы с данным недугом
Итак, как уже стало понятно, лечение возникшего недуга предусматривает, как правило, несколько этапов. При остро возникшем заболевании необходимо в экстренном порядке полностью исключить влияние факторов, приводящих к аноксии:
- Ребенку требуется санация дыхательных путей.
- Удаление инородного тела.
- Необходимо вынести пациента из зоны действия углекислого газа.
- Требуется прекращение странгуляции.
- Препятствование воздействию электрического тока.
На этом этапе необходимо поддерживать в норме кровообращение и поступление кислорода, в некоторых случаях используют аппараты искусственного дыхания. При этом поддержка осуществляется на уровне, который не должен допускать необратимых изменений в мозге. При наличии сохраненного естественного дыхания ребенку требуются кислородные ингаляции и транспортировка в стационар. В случае неэффективности дыхания потребуется интубация.
Восстановление витальных функций
Следующий этап предполагает восстановление витальных функций. Таким образом, необходимо восстановление кровяной циркуляции, дыхания и нормальной работы сердца. Дальше терапию направляют на восстановление всех ранее утраченных функций. В этих целях назначают нейрометаболиты наряду с ноотропами, сосудистыми препаратами, нейропротекторами и антиоксидантами.
Симптоматическая терапия направлена на устранение основного проявления последствий аноксии. В случае наличия выраженной головной боли используются анальгетики, а на фоне эпилептических припадков требуются антиконвульсанты и так далее.
Лекарства
Фото: grud.guru
При возникновении странной и резкой головной боли человек обязан немедленно обратиться в ближайшее медицинское заведение за квалифицированной помощью. Медикаментозно болезнь не лечат, но существует профилактика и реабилитация после операции.
Хирургическое вмешательство на сегодняшний день является единственным и самым перспективным методом лечения аневризмы. Лечение специальными препаратами используется только для стабилизации пациента или в той ситуации, когда оперативная операция противопоказана или вообще невозможна.
Химические препараты не способны устранить аневризму, они лишь снижают вероятность разрыва сосуда путем устранения критических факторов. Часть лекарственных средств входит в комплекс общей терапии, который направлен в первую очередь на облегчение симптоматики первоначальной патологии у пациентов. Какие же витамины и препараты принимаются при аневризме сосудов головного мозга?
Блокаторы для кальциевых каналов
Главный представитель группы нимодипин. Химический препарат надежно блокирует кальциевые каналы в мышечных клетках сосудистых стенок. Сосуды расширяются. Кровообращение в мозговых артериях значительно улучшается. Эти препараты просто незаменимы при профилактике опасных спазмов артерий.
Антациды
В основе принципа действия лежит блокировка H2 гистаминовых рецепторов желудка. В результате снижается его кислотность и значительно снижается секреция желудочного сока. В данную группу входит Ранитидин.
Противосудорожные препараты
На сегодняшний день Фосфенитоин является основным представителем данной группы. Препараты вызывают надежную стабилизацию мембран в нервных клетках. Патологические нервные импульсы заметно замедляются и не распространяются.
Противорвотные препараты
В основном применятся прохлорперазин. Уменьшается рвотный рефлекс за счет блокировки постсинаптического дофаминовых рецепторов в мезолимбическом отделении головного мозга.
Обезболивающие средства
Для устранения боли очень эффективен морфин. Уровень болевых ощущений снижается в результате воздействия на особые опиоидные рецепторы.
Антигипертензивные препараты
В последнее время применяются три основных препарата: лабеталол, каптоприл, гидралазин. За счет воздействия на ферменты и рецепторы уменьшается общий тонус артерий, предотвращается разрыв.